Pada tahun 1913, dengan menggabungkan dari teori Rutherford tadi, plank quantum hypotesis, Einstein's photon concept (dalam tajuk photoelectric effect). Bohr mencadangkan bahawa
1)Instead of a continuum of orbits, which are possible in classical mechanics, only a discrete set of circular stable orbits, called stationary states, are allowed. Atoms can exist only in certain stable states with definite energies: E1, E2, E3, etc.
2)The allowed (stationary) orbits correspond to those for which the orbital angular momentum of the electron is an integer multiple of h/(2π)
L = nh/(2π)
3) As long as an electron remains in a stationary orbit, it does not radiate electromagnetic
energy. Emission or absorption of radiation can take place only when an electron jumps
from one allowed orbit to another. The radiation corresponding to the electron’s transition
from an orbit of energy En to another Em is carried out by a photon of energy hv = En - Em.
Penjelasan
1) Electron bergerak dalam orbit tertentu dan orbit tersebut adalah bulat dan bukan dalam keadaan elips seperti planet. (dalam classical, elips dan bulat adalah diterima).

Bohr model Rutherford Model
Jadi, perasan bukan? elektron tak bersepah, tapi bergerak dalam orbit tertentu dan tidak berterusan dalam tenaga yang pasti iaitu, E1, E2, E3, ...
2) Elektron hanya akan berada dalam orbit yang dibenarkan sahaja dan elektron tidak memancarkan radiasi apabila berada dalam orbit tertentu.

Jadi selagi elektron tidak menerima atau kehilangan tenaga, maka dia akan kekal dalam orbit tersebut. Ianya berkadang langsung dengan orbital angular momentum orbit tersebut. Dan, angular momentum elektron tersebut adalah dalam kuantiti yang tetap, tidak berterusan.
3) Elektron akan memancarkan tenaga apa bila dia "jatuh" dari orbit tinggi ke orbit rendah.

Dalam gambar diatas, elektron telah berubah tempat dari orbit 3 (tinggi) ke orbit 2 (rendah). Dan tenaga dilepaskan adalah berdasarkan rumus:
E=nhf.
E - tenaga
n - quantum number
h - plank constant
f - frekuensi
4) Apabila elektron menerima tenaga, dia akan "melompat" dari orbit rendah ke orbit tinggi.
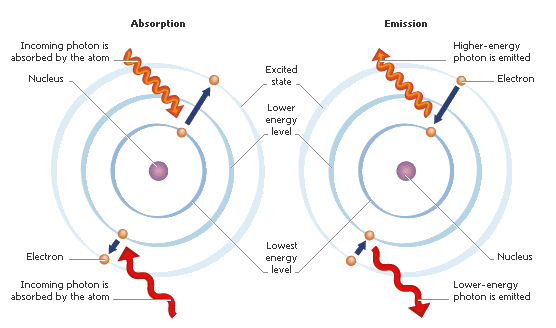
Seperti dalam gambar sebelah kiri (absorption), atom akan terima tenaga dan "melompat" dari orbit rendah ke orbit tinggi.

